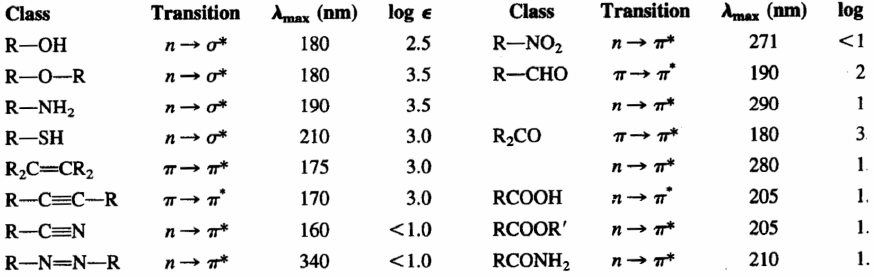
- Alcanos. Sus bandas de absorción son debidas a transiciones $\sigma\rightarrow\sigma^{\ast}$ de enlaces C-C y C-H. Estas transiciones son de elevada energía y tienen lugar a longitudes de onda inferiores a los 150 nm, no observables por tanto en espectrofotómetros convencionales. Esta característica permite utilizarlos como disolventes de la muestar a anlizar, ya que no interfieren con sus señales.
- Alquenos y alquinos. Presentan bandas de absorción debidas a las transiciones $\pi\rightarrow\pi^{\ast}$ del triple enlace C-C. Esta transición es de menor energía que en el caso de los alcanos y aparece a longitudes de onda mayores (alquenos:175 nm; alquinos: 170 nm). El doble y triple enlace son los grupos cromóforos de estas moléculas.
- Éteres, tioles, sulfuros, aminas: En este caso el grupo cromóforo está formado por el heteroátomo (O,S,N) y los átomos que le enlazan. El heteroátomo presenta pares libres y la transición que produce la absorción es $n\rightarrow\sigma^{\ast}$. Esta banda de absorción aparece sobre 175-200 nm para alcoholes, éteres y aminas, desplazándose a 200-220 nm para los sulfuro.
- Aldehídos, cetonas, ácidos y derivados. El grupo cromóforo de estos compuestos es el carbonilo (C=O). Dado que el oxígeno posee pares libres, la transición de menor energía es la $n\rightarrow\pi^{\ast}$, pero es una transición prohibida ($\epsilon_{max}=15$), al no existir solapamiento entre los orbitales implicados. La siguiente transición de menor energía es la $\pi\rightarrow\pi^{\ast}$, observable a $\lambda_{max}=188\;nm$, con absortividad molar de 900.
En la siguiente tabla se indican las absorciones de los principales grupos cromóforos.