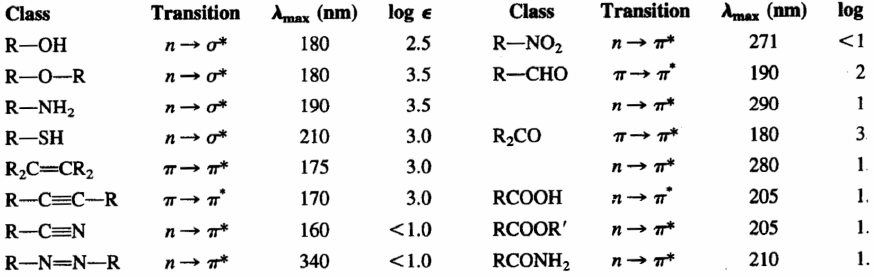
- Alcanes. Ses bandes d'absorption sont dues aux transitions $\sigma\rightarrow\sigma^{\ast}$ des liaisons CC et CH. Ces transitions sont de haute énergie et ont lieu à des longueurs d'onde inférieures à 150 nm, donc non observables dans les spectrophotomètres conventionnels. Cette caractéristique permet de les utiliser comme solvants de l'échantillon à analyser, car ils n'interfèrent pas avec leurs signaux.
- Alcènes et alcynes. Ils montrent des bandes d'absorption dues aux transitions $\pi\rightarrow\pi^{\ast}$ de la triple liaison CC. Cette transition est de plus faible énergie que dans le cas des alcanes et apparaît à des longueurs d'onde plus grandes (alcènes : 175 nm ; alcynes : 170 nm). La double et la triple liaison sont les groupes chromophores de ces molécules.
- Ethers, thiols, sulfures, amines : Dans ce cas, le groupement chromophore est formé par l'hétéroatome (O,S,N) et les atomes qui le relient. L'hétéroatome présente des paires isolées et la transition qui produit l'absorption est $n\rightarrow\sigma^{\ast}$. Cette bande d'absorption apparaît vers 175-200 nm pour les alcools, les éthers et les amines, passant à 200-220 nm pour les sulfures.
- Aldéhydes, cétones, acides et dérivés. Le groupe chromophore de ces composés est le carbonyle (C=O). Puisque l'oxygène a des paires isolées, la transition avec la plus faible énergie est $n\rightarrow\pi^{\ast}$, mais c'est une transition interdite ($\epsilon_{max}=15$), car il n'y a pas de chevauchement entre les orbitales impliquées. La prochaine transition d'énergie la plus basse est $\pi\rightarrow\pi^{\ast}$, observable à $\lambda_{max}=188\;nm$, avec une absorptivité molaire de 900.
Le tableau suivant montre les absorptions des principaux groupes chromophores.