-
Detalhes
-
Germán Fernández
-
FÓRMULAS MOLECULARES
-
Acessos: 86362
Atualmente, são conhecidos mais de 30 milhões de compostos químicos, dos quais 1 milhão são inorgânicos e o restante são orgânicos. Os químicos determinam as propriedades físicas e químicas dessas substâncias (pontos de fusão e ebulição, solubilidade, densidade...). No entanto, a informação mais cobiçada pelo químico é a determinação da estrutura do composto, que tipo de átomos o compõem e como esses átomos estão ligados.
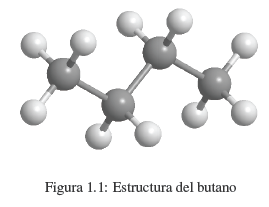
Sabemos que uma substância como o butano é composta de carbono e hidrogênio. Cada molécula contém 4 átomos de carbono e 10 átomos de hidrogênio, o que é representado pela fórmula C 4 H 10 , chamada de fórmula molecular. Também sabemos que os átomos de carbono estão ligados para formar uma cadeia linear. 3 hidrogênios estão ligados ao primeiro carbono, 2 hidrogênios ao segundo carbono, 2 hidrogênios ao terceiro carbono e os últimos 3 hidrogênios ao quarto carbono.
Ler mais: Fórmulas Moleculares
-
Detalhes
-
Germán Fernández
-
FÓRMULAS MOLECULARES
-
Acessos: 95382
Consiste em determinar experimentalmente a composição percentual (em massa) de uma substância. Assim, para um composto com fórmula molecular C 4 H 10 a composição percentual é: 82,66% C e 17,34% H.
A análise elementar de um composto é realizada em um aparelho, denominado analisador, onde uma amostra pesada é queimada com grande precisão (cerca de 5 mg). O carbono é transformado em CO 2 , o hidrogênio em H 2 O e o nitrogênio em N 2 , determinado por cromatografia gasosa. O oxigênio geralmente não é analisado e é determinado por diferença.
Ler mais: Análise Elemental
-
Detalhes
-
Germán Fernández
-
FÓRMULAS MOLECULARES
-
Acessos: 89031
A partir da composição centesimal de um composto químico podemos determinar sua fórmula empírica. A fórmula molecular é obtida a partir da empírica usando a massa molecular do composto, que pode ser determinada por espectrometria de massas.
Determinação da fórmula empírica e molecular da cortisona
A composição percentual da cortisona é: 69,96% de C; 7,83% H e 22,21% O. Determine a fórmula empírica. Sabendo que a massa molecular é 360,43, obtenha a fórmula molecular.
Ler mais: Cálculo de fórmulas empíricas e moleculares
-
Detalhes
-
Germán Fernández
-
FÓRMULAS MOLECULARES
-
Acessos: 80779
O índice de insaturação de uma molécula é definido como a soma do número de ligações \(\pi\) e o número de ciclos presentes. Os alcanos são hidrocarbonetos saturados, pois não contêm ligações ou ciclos \(\pi\) e possuem a fórmula molecular \(C_nH_{2n+2}\). Para calcular o índice de insaturação de um composto, basta comparar o número de hidrogênios que ele possui com os que teria se fosse um alcano com o mesmo número de carbonos. Essa diferença de hidrogênio dividida por 2 nos dá o índice de insaturação.
Alcenos são compostos que contêm ligações duplas carbono-carbono. Os alcenos respondem à fórmula molecular \(C_nH_{2n}\). Para o mesmo número de carbonos, eles têm dois hidrogênios a menos que um alcano, são chamados de compostos insaturados (eles têm insaturação).
Ler mais: índice de insaturação