TEORI BENZENA
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 149149
Benzena monosubstitusi diberi nama dengan mengakhiri nama substituen dalam benzena.
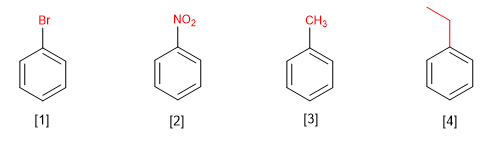
[1] Bromobenzena
[2] Nitrobenzena
[3] Metilbenzena (toluena)
[4] Etilbenzena
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 86048
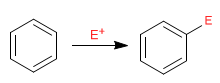
Benzena bertindak sebagai nukleofil, menyerang sejumlah besar dan beragam elektrofil.
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 125890
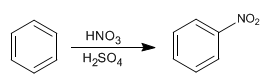
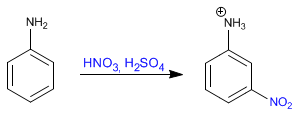
Benzena bereaksi dengan campuran nitrat-sulfat yang menambahkan gugus nitro.
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 116389
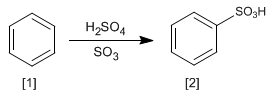
Reaksi benzena [1] dengan larutan sulfur trioksida dalam asam sulfat menghasilkan asam benzenasulfonat [2].
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 101088
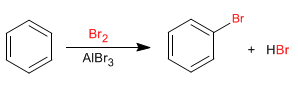
Benzena bereaksi dengan halogen dengan adanya asam Lewis untuk membentuk turunan halogenasi.
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 72300
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 2034
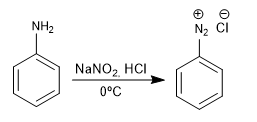
Gugus amino dimasukkan ke dalam cincin aromatik dengan mereduksi nitro.
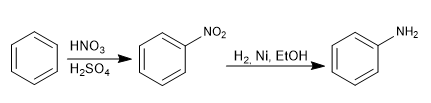
Reagen yang digunakan dalam reduksi dapat berupa:
- Sn, HCl
- H2 , Ni, EtOH
- Fe, HCl
Selengkapnya: Reduksi nitro menjadi amino dan oksidasi amino menjadi nitro
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 1780
Reversibilitas sulfonasi memungkinkannya digunakan untuk melindungi posisi aktif benzena. Mari kita lihat contohnya:
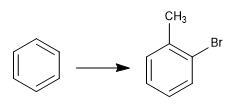
Untuk mendapatkan o-bromotoluene, kami melakukan langkah-langkah berikut:
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 2329
Reaksi 1-kloro-2,4-dinitrobenzena dengan nukleofil (hidroksida, amonia, metoksida, dll.) menghasilkan substitusi klorin oleh nukleofil yang sesuai. Disebut ipso (tempat yang sama), untuk menunjukkan bahwa nukleofil menempati posisi yang sama dengan klorin awal.
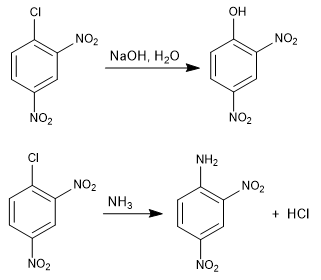
Selengkapnya: Substitusi nukleofilik aromatik dengan adisi-eliminasi
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 54469
Benzena terhalogenasi bereaksi dengan soda encer pada kondisi tekanan dan suhu tinggi untuk membentuk fenol. Reaksi ini tidak memerlukan penonaktifan gugus pada posisi orto/para dan mengikuti mekanisme yang berbeda dari substitusi nukleofilik aromatik melalui adisi-eliminasi.
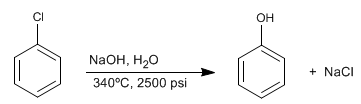
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 1986
Karbon yang melekat langsung pada benzena dikenal sebagai posisi benzilik. Pada posisi ini, karbokation, karbanion, dan radikal yang sangat stabil terbentuk karena kemungkinan delokalisasi muatan pada cincin aromatik.
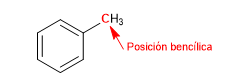
S N 1 dalam posisi benzilik
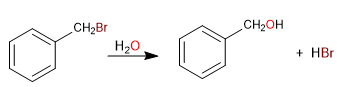
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 1985
Oksidasi rantai dengan permanganat dan dikromat
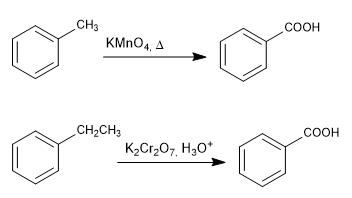
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 1863
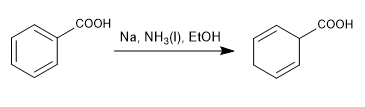
Reduksi Birch menggunakan natrium atau litium dalam larutan sebagai reagen, mekanismenya radikal dan mereduksi benzena menjadi 1,4-sikloheksadiena.
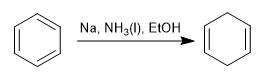
Birch dengan substituen pengaktif
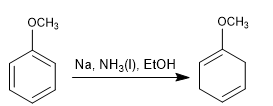
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 1842
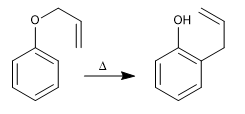
Alil fenil eter mengalami reaksi bersama ketika dipanaskan, melibatkan pergerakan enam elektron, yang disebut penataan ulang Claisen. Zat antara yang terbentuk dalam reaksi berenergi tinggi dan dengan cepat mengalami tautomerisasi untuk menghasilkan produk akhir.
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 1889
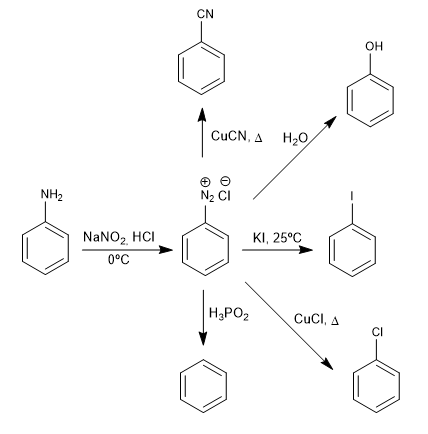
Garam benzenadiazonium diserang oleh nukleofil dengan adanya garam tembaga (I) yang bertindak sebagai katalis, memperoleh berbagai macam produk.
- Detail
- Germán Fernández
- TEORI BENZENA
- Dilihat: 1889
Pembentukan senyawa azo