THÉORIE DU BENZÈNE
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 148835
Les benzènes monosubstitués sont nommés en terminant le nom du substituant en benzène.
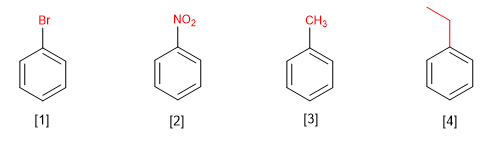
[1] Bromobenzène
[2] Nitrobenzène
[3] Méthylbenzène (toluène)
[4] Éthylbenzène
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 85851
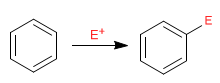
Le benzène agit comme un nucléophile, attaquant un nombre important et varié d'électrophiles.
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 124372
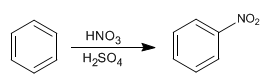
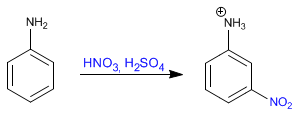
Le benzène réagit avec le mélange nitrique-sulfurique en ajoutant des groupes nitro.
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 115719
La réaction du benzène [1] avec une solution de trioxyde de soufre dans l'acide sulfurique produit des acides benzènesulfoniques [2].
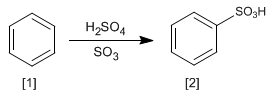
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 100562
Le benzène réagit avec les halogènes en présence d'acides de Lewis pour former des dérivés halogénés.
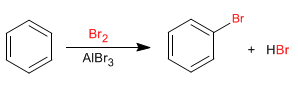
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 71933
Lire la suite : Benzène - Protection et déprotection du groupe amino
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 1713
Le groupe amino est introduit dans le cycle aromatique par réduction du nitro.
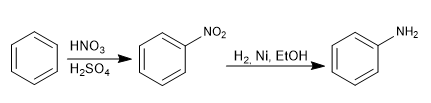
Les réactifs utilisés dans la réduction peuvent être :
- Sn, HCl
- H2 , Ni, EtOH
- Fe, HCl
Lire la suite : Réduction de nitro en amino et oxydation d'amino en nitro
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 1545
La réversibilité de la sulfonation permet de l'utiliser pour protéger les positions activées du benzène. Voyons un exemple :
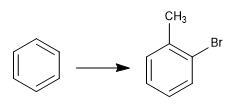
Pour obtenir l'o-bromotoluène, nous effectuons les étapes suivantes :
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 1953
La réaction du 1-chloro-2,4-dinitrobenzène avec des nucléophiles (hydroxyde, ammoniac, méthylate, etc.) produit la substitution du chlore par le nucléophile correspondant. On l'appelle ipso (même place), pour indiquer que le nucléophile occupe la même position que le chlore de départ.
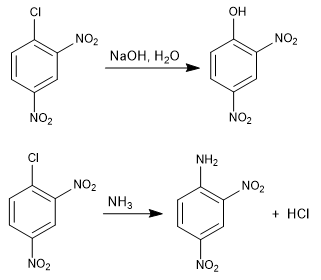
Lire la suite : Substitution nucléophile aromatique par addition-élimination
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 54257
Les benzènes halogénés réagissent avec la soude diluée dans des conditions de pression et de température élevées pour former des phénols. Cette réaction ne nécessite pas de groupements désactivants en position ortho/para et suit un mécanisme différent de la substitution nucléophile aromatique par addition-élimination.
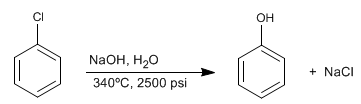
Lire la suite : Substitution Nucléophile Aromatique: Benzine
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 1930
Le carbone attaché directement au benzène est connu sous le nom de position benzylique. Dans cette position, des carbocations, des carbanions et des radicaux très stables sont formés en raison de la possibilité de délocaliser la charge sur le cycle aromatique.
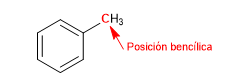
S N 1 en positions benzyliques
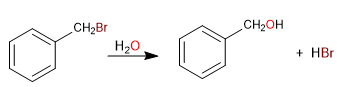
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 1882
Oxydation en chaîne avec permanganate et bichromate
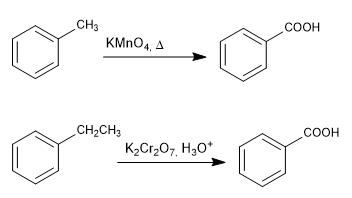
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 2214
La réduction de Birch utilise du sodium ou du lithium en solution comme réactifs, son mécanisme est radical et réduit le benzène en 1,4-cyclohexadiène.
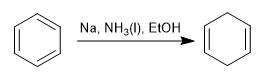
Birch avec substituants activateurs
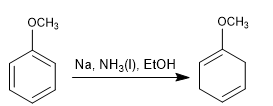
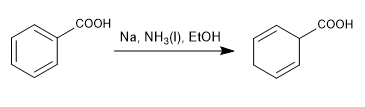
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 1939
Les allyl phényl éthers subissent une réaction concertée lorsqu'ils sont chauffés, impliquant le mouvement de six électrons, appelé réarrangement de Claisen. L'intermédiaire formé dans la réaction est de haute énergie et se tautomérise rapidement pour donner le produit final.
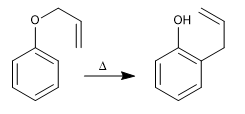
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 1946
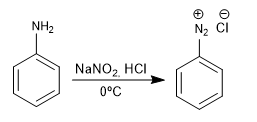
Les sels de benzènediazonium sont attaqués par des nucléophiles en présence de sels de cuivre (I) qui agissent comme catalyseur, obtenant une grande variété de produits.
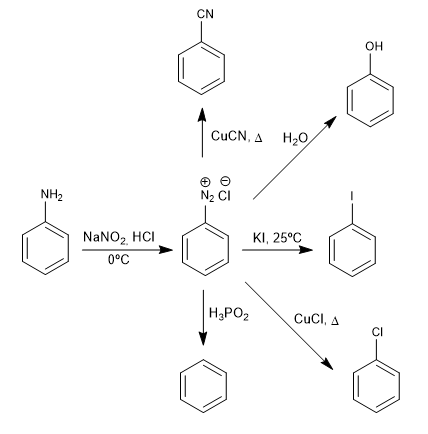
- Détails
- Germán Fernández
- THÉORIE DU BENZÈNE
- Affichages : 2009
Formation de composés azoïques