Organische Moleküle verteilen ihre Elektronen in verschiedenen elektronischen Ebenen, die als Molekülorbitale bezeichnet werden. Die Molekülorbitale mit der niedrigsten Energie sind $\sigma$, gefolgt von $\pi$-Orbitalen. Wenn im Molekül Atome mit freien Elektronenpaaren (Sauerstoff, Schwefel, Stickstoff, Halogene) vorhanden sind, haben wir nichtbindende Ebenen n. Diese elektronischen Ebenen sind im Verbindungsbereich des Diagramms angeordnet. Im antibindenden Bereich finden wir die Molekülorbitale $\pi^{\ast}$ und $\sigma^{\ast}$. Ein Molekül in seinem Grundzustand hat besetzte bindende und nichtbindende Orbitale und unbesetzte antibindende Orbitale.
Aus dem oben Erläuterten lässt sich ableiten, dass die elektronischen Übergänge von den bindenden und nichtbindenden Orbitalen ausgehen und in den antibindenden enden müssen. Somit können wir die 5 Arten von elektronischen Übergängen haben, die im folgenden Diagramm gezeigt werden.
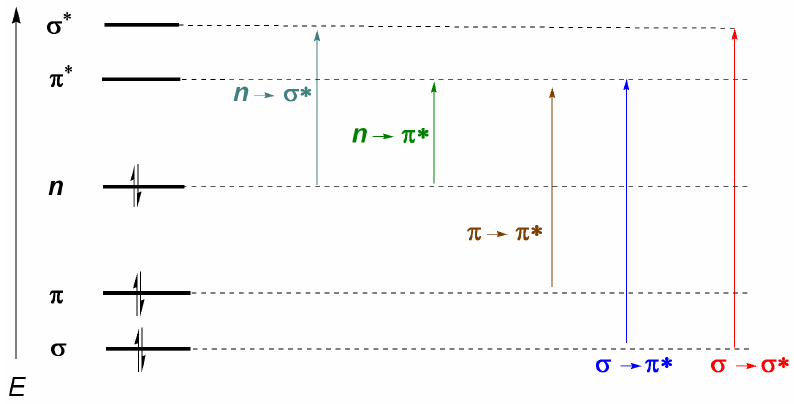
Der wichtigste elektronische Übergang ist normalerweise vom HOMO (letztes besetztes Orbital) zum LUMO (erstes leeres Orbital), was dem kleinsten energetischen Sprung entspricht und einer langen Wellenlänge entspricht.
Bei Alkanen sind nur $\sigma \rightarrow \sigma^{\ast}$-Übergänge möglich (Ethan: $\lambda =135\;nm$). Diese Banden können mit kommerziellen Spektralphotometern nicht beobachtet werden, da sie ab 200 nm scannen. Moleküle mit konjugierten Doppelbindungen weisen jedoch $\pi \rightarrow \pi^{\ast}$-Übergänge auf, die beobachtet werden können (Butadien: $\lambda =217\;nm$).
Wenn Atome mit freien Elektronenpaaren im Molekül vorhanden sind, ist der Übergang mit der niedrigsten Energie (größte Wellenlänge) $n\rightarrow \pi$. Es ist jedoch ein unwahrscheinlicher Übergang, da es keine Überlappung zwischen beiden Orbitalen gibt, was zu sehr schwachen Bändern führt. Aus diesem letzten Kommentar folgt die Auswahlregel für die UV-Vis-Spektroskopie: $n\rightarrow \pi^{\ast}$ Übergänge sind "verboten". Ein Übergang mit geringer Wahrscheinlichkeit wird als verboten verstanden.









