Органические молекулы распределяют свои электроны на разных электронных уровнях, называемых молекулярными орбиталями. Молекулярные орбитали с наименьшей энергией – это $\sigma$, за которыми следуют $\pi$-орбитали. При наличии в молекуле атомов со свободными электронными парами (кислород, сера, азот, галогены) мы будем иметь несвязывающие уровни n. Эти электронные уровни расположены в области связи диаграммы. В области разрыхления находятся молекулярные орбитали $\pi^{\ast}$ и $\sigma^{\ast}$. Молекула в основном состоянии имеет занятые связывающие и несвязывающие орбитали и незанятые разрыхляющие орбитали.
Из сказанного выше можно сделать вывод, что электронные переходы должны начинаться со связывающих и несвязывающих орбиталей и заканчиваться на разрыхляющих. Таким образом, мы можем иметь 5 типов электронных переходов, показанных на следующей диаграмме.
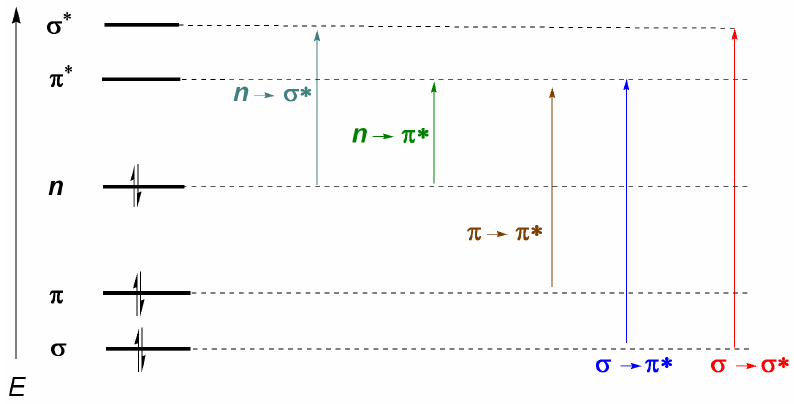
Самый важный электронный переход обычно происходит с ВЗМО (последняя занятая орбиталь) на НСМО (первая пустая орбиталь), что соответствует наименьшему энергетическому скачку и соответствует большой длине волны.
В алканах возможны только $\sigma \rightarrow \sigma^{\ast}$ переходы (этан: $\lambda =135\;nm$). Эти полосы невозможно наблюдать с помощью коммерческих спектрофотометров, поскольку они сканируют от 200 нм. Однако молекулы, имеющие сопряженные двойные связи, представляют переходы $\pi \rightarrow \pi^{\ast}$, которые можно наблюдать (бутадиен: $\lambda =217\;nm$).
При наличии в молекуле атомов с неподеленными парами переход с наименьшей энергией (наибольшей длиной волны) равен $n\rightarrow \pi$. Однако это маловероятный переход, поскольку обе орбитали не перекрываются, что приводит к очень слабым полосам. Из этого последнего комментария следует правило отбора для УФ-видимой спектроскопии: переходы $n\rightarrow \pi^{\ast}$ "запрещены". Под маловероятным переходом понимается запрещенный.









