Espectroscopía visible-Ultravioleta
ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 94865
La espectroscopía estudia la interacción entre la radiación electromagnética y la materia. En esta interacción la radiación electomagnética puede comportarse como onda o como partícula, aunque no se ha observado ningún fenómeno físico en el que ambos comportamientos se den simultáneamente.
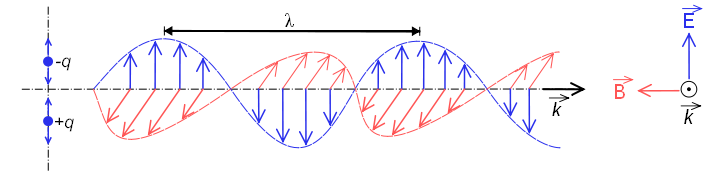
Cuando se comporta como onda, está constituida por un campo eléctrico y otro magnético que oscilan perpendiculares y se propagan a la velocidad de la luz $c=300000\;km/s$
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 21223
Existen tres zonas del espectro electromagnético con especial interés en la determinación de compuestos químicos:
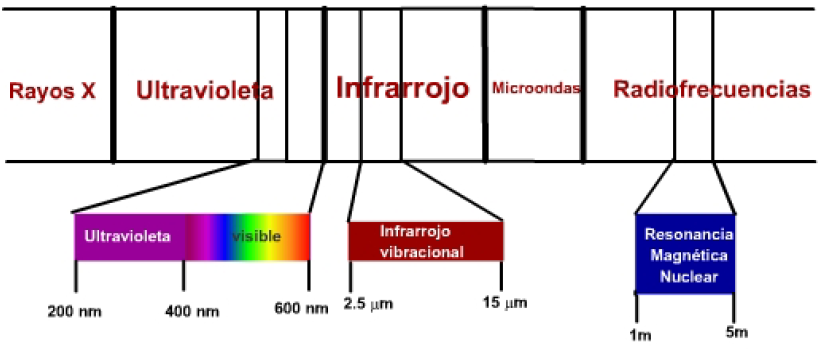
- La radiación visible-ultravioleta posee una energía adecuada para producir transiciones de electrones moleculares a niveles de energía superior. Es la denominada espectroscopía UV, cuya utilidad se limita principalmente a la determinación de moléculas con insaturaciones.
- La radiación infrarroja produce transiciones entre niveles vibracionales de una molécula. Los enlaces entre los átomos de una molécula no son rígidos, sino que vibran en torno a una posición de equilibrio y la radiación infrarroja es capaz de llevar estos enlaces a niveles de energía vibracional superiores. Es la denominada espectroscopía infrarroja (IR).
- Las ondas de radio poseen la energía adecuada para para hacer que los núcleos atómicos, sometidos a un campo magnético, entren en resonancia. Esta técnica se denomina espectroscopía de resonancia magnética nuclear (RMN).
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 33440
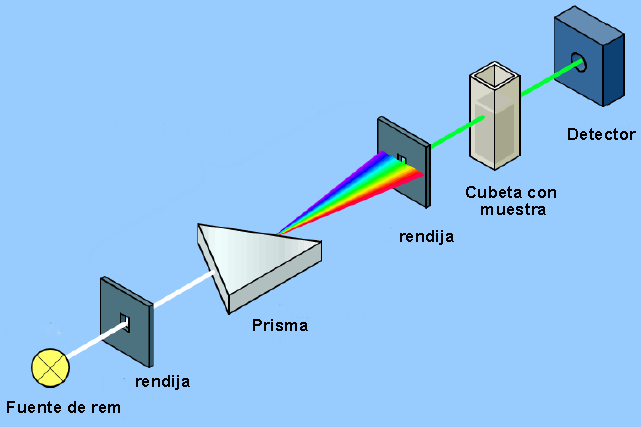
El instrumento que permite detectar la interacción entre la radiación electromagnética y la materia recibe el nombre de espectrofotómetro y su estructura básica puede observarse en el siguiente esquema.
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 46316
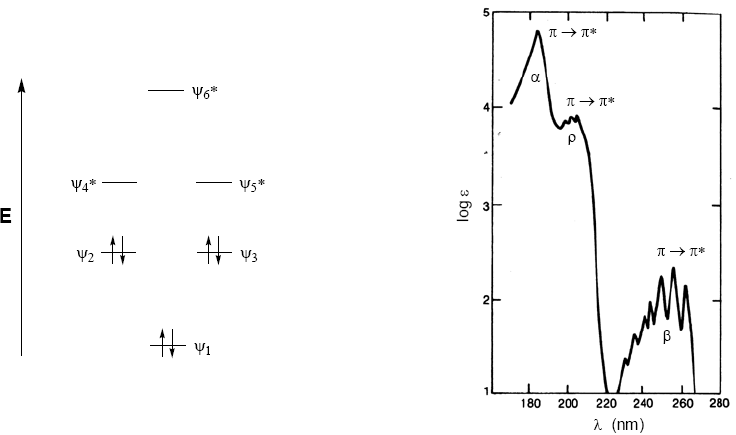
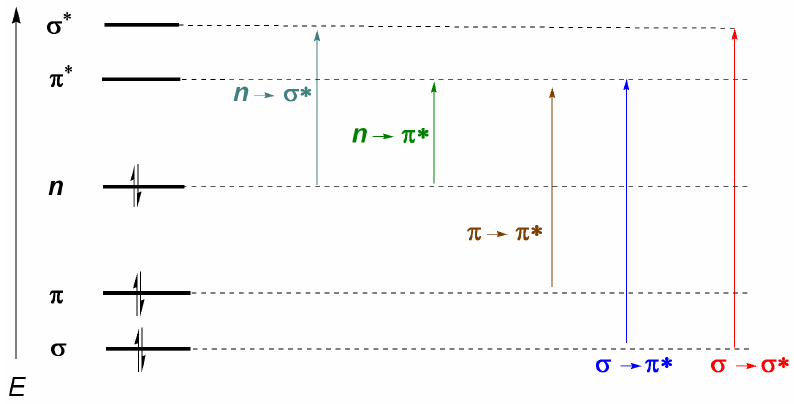
Las moléculas orgánicas distribuyen sus electrones en diferentes niveles electrónicos llamados orbitales moleculares. Los orbitales moleculares de menor energía son los $\sigma$, a continuación siguen los orbitales $\pi$. Cuando en la molécula existen átomos con pares electrónicos libres (oxígeno, azufre, nitrógeno, halógenos) tendremos niveles no enlazantes n. Estos niveles electrónicos se disponen en la región enlazante del diagrama. En la región antienlazante nos encontramos con los orbitales moleculares $\pi^{\ast}$ y $\sigma^{\ast}$. Una molécula en su estado fundamental tiene ocupados los orbitales enlazantes y no enlazantes y desocupados los antienlazntes.
De lo comentado anteriormente se deduce que las transiciones electrónicas deben partir de los orbitales enlazantes y no enlazantes terminando en los antienlazantes. Así podemos tener los 5 tipos de transiciones electrónicas que se muestran en el siguiente diagrama.
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 53548
La Ley de Lambert-Beer introduce el concepto de absorbancia (A) de una muestra como $A=log\frac{I}{I_0}$. Donde $I_0$ representa la intensidad de la luz incidente e I la intensidad de la luz que atraviesa la celda. También podemos expresar la absorbancia en función de la longitud de la cubeta y de la concentración de soluto. \begin{equation} A=log\frac{I_0}{I}=\epsilon\cdot c\cdot l \end{equation} Donde $l$ es la longitud de la cubeta en cm, $c$ representa la concentración de soluto en mol/l y $\epsilon$ es la absortividad molar (coeficiente de extinción molar) medido en l/mol.cm.
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 24682
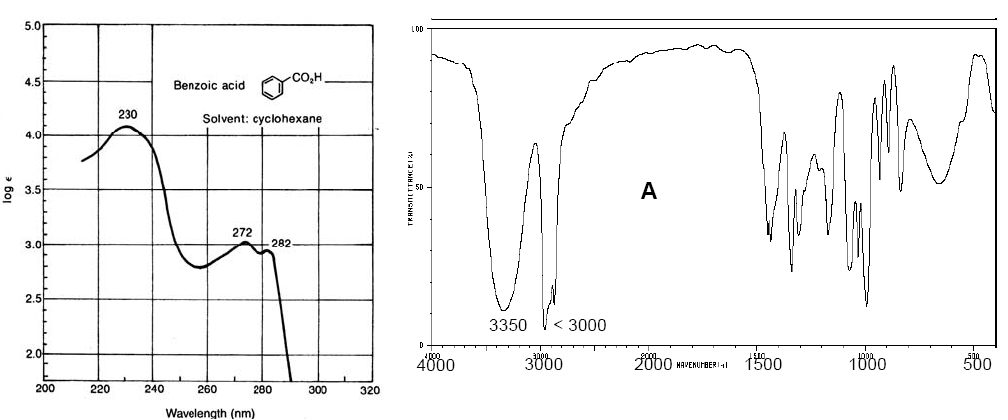 Espectro vis-UV del ácido benzoico (izq). Espectro IR del ciclopentanol (dcha)
Espectro vis-UV del ácido benzoico (izq). Espectro IR del ciclopentanol (dcha)
Los espectros vis-UV tienen una resolución más baja que los de IR debido a que cada nivel electrónico se divide en niveles vibracionales y estos a su vez en niveles rotacionales, de manera que una transición electrónica consta de un amplio conjunto de transiciones roto-vibracionales. Los espectros de IR también poseen bandas de una amplitud considerable debido a las transiciones rotacionales que se producen simultáneamente a las transiciones vibracionales.
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 80307
Los grupos cromóforos son los grupos funcionales de la molécula responsables de la absorción. Principalmente son: dobles y triples enlaces carbono-carbono, sistemas aromáticos, grupo carbonilo, imino (C=N), diazo (N=N), nitro y enlaces C-Y (Y es un átomo con pares libres).
Los grupos auxocromos son sustituyentes del cromóforo y alteran $\lambda_{max}$ y/o $\epsilon_{max}$. Son auxocromos los grupos metilo, halógenos, hidroxi, alcoxi, amino.
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 39065
- Alcanos. Sus bandas de absorción son debidas a transiciones $\sigma\rightarrow\sigma^{\ast}$ de enlaces C-C y C-H. Estas transiciones son de elevada energía y tienen lugar a longitudes de onda inferiores a los 150 nm, no observables por tanto en espectrofotómetros convencionales. Esta característica permite utilizarlos como disolventes de la muestar a anlizar, ya que no interfieren con sus señales.
- Alquenos y alquinos. Presentan bandas de absorción debidas a las transiciones $\pi\rightarrow\pi^{\ast}$ del triple enlace C-C. Esta transición es de menor energía que en el caso de los alcanos y aparece a longitudes de onda mayores (alquenos:175 nm; alquinos: 170 nm). El doble y triple enlace son los grupos cromóforos de estas moléculas.
- Éteres, tioles, sulfuros, aminas: En este caso el grupo cromóforo está formado por el heteroátomo (O,S,N) y los átomos que le enlazan. El heteroátomo presenta pares libres y la transición que produce la absorción es $n\rightarrow\sigma^{\ast}$. Esta banda de absorción aparece sobre 175-200 nm para alcoholes, éteres y aminas, desplazándose a 200-220 nm para los sulfuro.
- Aldehídos, cetonas, ácidos y derivados. El grupo cromóforo de estos compuestos es el carbonilo (C=O). Dado que el oxígeno posee pares libres, la transición de menor energía es la $n\rightarrow\pi^{\ast}$, pero es una transición prohibida ($\epsilon_{max}=15$), al no existir solapamiento entre los orbitales implicados. La siguiente transición de menor energía es la $\pi\rightarrow\pi^{\ast}$, observable a $\lambda_{max}=188\;nm$, con absortividad molar de 900.
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 25847
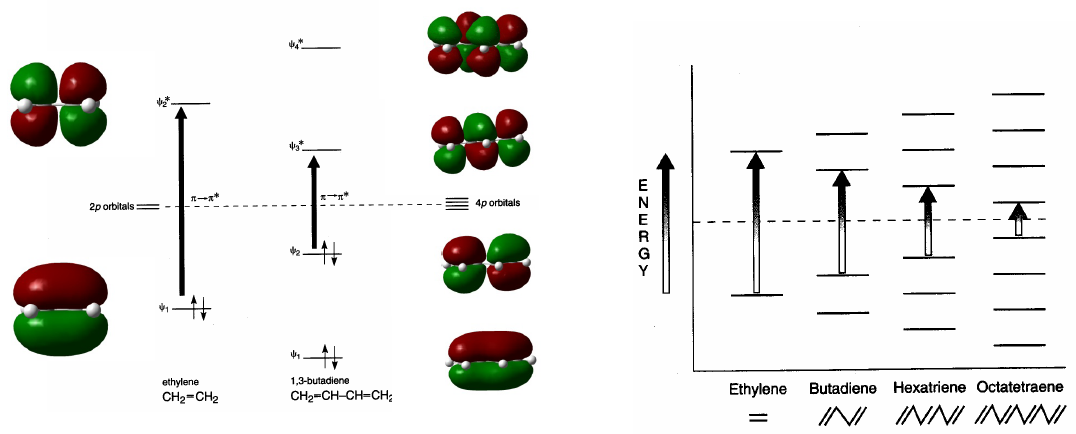
Los sistemas conjugados absorben a mayores longitudes de onda que los no conjugados. A medida que la conjugación aumenta decrece la diferencia energética entre HOMO y LUMO y la radiación necesaria para producir la transición $\pi \rightarrow \pi^{\ast}$ disminuye su longitud de onda.
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 16869
El diagrama de orbitales moleculares del $\alpha,\beta$-insaturado se construye a partir de los orbitales moleculares del eteno y del carbonilo
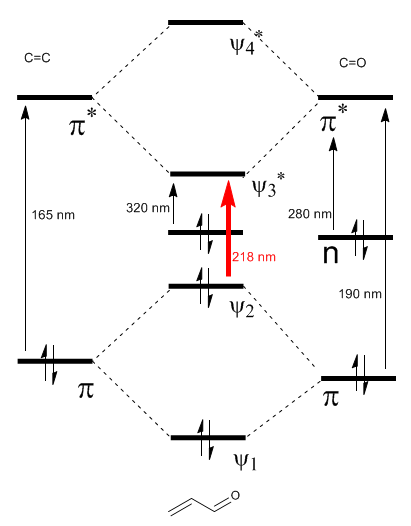
Leer más: Efecto batocrómico en carbonilos $\alpha,\beta$-insaturados
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 16079
Como puede observarse en el diagrama la conjugación con los pares libres del grupo X produce un acercamiento entre los orbitales HOMO y LUMO, dando lugar a una transición de menor energía (mayor longitud de onda) que en el eteno.
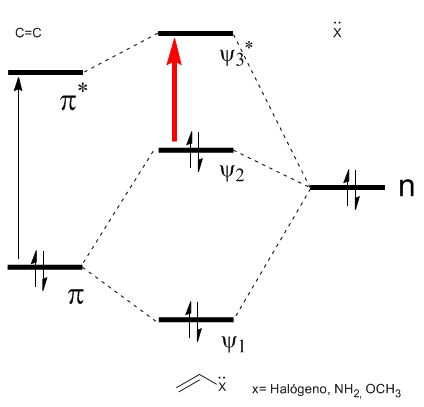
- Detalles
- Germán Fernández
- ESPECTROSCOPÍA VISIBLE-ULTRAVIOLETA
- Visto: 28115
El espectro de absorción del benceno consta de tres bandas a 184, 204 y 256 nm, que suelen denominarse $\alpha$, p y $\beta$. Las bandas $\alpha$, p tambien se conocen como primarias y la $\beta$ banda secundaria. La banda secundaria es amplia debido a su estructura vibracional.