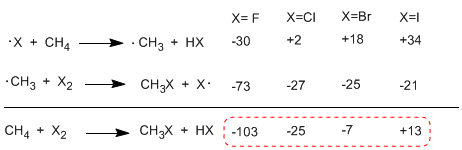TEORIA REAZIONI DI ALOGENAZIONE
- Dettagli
- Germán Fernández
- TEORIA REAZIONI DI ALOGENAZIONE
- Visite: 929
Gli alcani reagiscono con gli alogeni attraverso meccanismi radicalici. Detta reazione presuppone la sostituzione di uno o più idrogeni dell'alcano con alogeni.
Meccanismo di alogenazione radicalica
Il meccanismo di alogenazione radicalica consiste in tre fasi: inizio, propagazione e terminazione. All'inizio, la molecola dell'alogeno si rompe omoliticamente, generando radicali. Nella fase di propagazione avviene la sostituzione degli idrogeni dell'alcano con gli alogeni. Quando i reagenti sono esauriti, i radicali nel mezzo si uniscono tra loro, producendo lo stadio di terminazione.
Reattività alogena
Il primo stadio di propagazione determina la velocità della reazione. Per il fluoro, questo stadio ha una bassa energia di attivazione, che rende il fluoro l'alogeno più reattivo. Nel caso dello iodio, l'energia di attivazione è molto alta e la reazione non avviene. Ordine di reattività nelle reazioni radicaliche: $F_2>Cl_2>Br_2>I_2$. In breve, lo iodio non è reattivo nell'alogenazione radicale e il fluoro reagisce violentemente.
Polialogenazioni
La reazione di alogenazione è difficile da arrestare, poiché il prodotto alogenato è più reattivo dell'alcano di partenza. Per evitare questo problema, chiamato polialogenazioni, viene utilizzato un eccesso di alcano.
Stabilità radicale
Il meccanismo di queste reazioni avviene con la formazione di un intermedio detto radicale la cui stabilità dipende dal numero di sostituenti che circondano il carbonio che contiene l'elettrone solitario. I radicali formati nella fase di propagazione sono stabilizzati dall'iperconiugazione. L'ordine di stabilità dei radicali è dato da: terziario> secondario> primario.
- Dettagli
- Germán Fernández
- TEORIA REAZIONI DI ALOGENAZIONE
- Visite: 48319
MECCANISMO DI REAZIONE
Le alogenazioni radicalica avvengono in tre fasi chiamate: iniziacione, propagazione e terminazione:
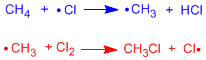
fase di iniziazione
Nella prima fase della reazione avviene la scissione omolitica del legame Cl-Cl. Ciò si ottiene con il calore o assorbendo la luce.
![]()
- Dettagli
- Germán Fernández
- TEORIA REAZIONI DI ALOGENAZIONE
- Visite: 24182
Andiamo a rappresentare in un diagramma energetico i due stadi di propagazione dell'alogenazione del metano.
Il primo stadio di propagazione è quello che limita la velocità del processo, ha la più alta energia di attivazione. Il diagramma rappresenta reagenti, prodotti, intermedi e stati di transizione per l'alogenazione radicale del metano.
- Dettagli
- Germán Fernández
- TEORIA REAZIONI DI ALOGENAZIONE
- Visite: 19930
Confrontando le entalpie degli stadi di propagazione dei diversi alogeni si osservano differenze importanti nei calori scambiati. Nel caso del fluoro, entrambi gli stadi sono esotermici (anche l'estrazione dell'idrogeno) con un bilancio energetico globale di -103 Kcal/mol. Le energie di attivazione degli stati di transizione in questa reazione sono molto basse, rendendolo l'alogeno più reattivo.
All'altro estremo della reattività c'è lo iodio, la cui reazione è endotermica e non avviene.
Ordine di reattività F2 > Cl2 > Br2 > I2
La tabella seguente mostra il calore scambiato negli stadi di propagazione per l'alogenazione del metano.
La reazione è fortemente esotermica nel caso del fluoro (alogeno più reattivo) mentre nel caso dello iodio è endotermica a 13 Kcal/mol.
- Dettagli
- Germán Fernández
- TEORIA REAZIONI DI ALOGENAZIONE
- Visite: 20222
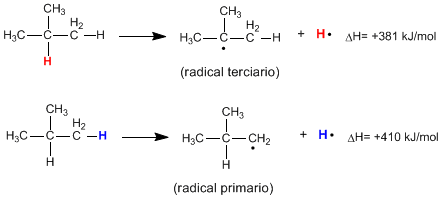
La rottura omolitica del legame C-H di un alcano produce radicali alchilici e atomi di idrogeno liberi. L'energia necessaria perché avvenga questa rottura è detta energia di dissociazione ed è tanto minore quanto più stabile è il radicale formatosi.
Come si può vedere dalle seguenti reazioni, l'energia richiesta per rompere un legame CH primario è molto più alta di quella richiesta per rompere un legame CH terziario.
Leggi tutto: Stabilità radicale nelle alogenazioni radicaliche
- Dettagli
- Germán Fernández
- TEORIA REAZIONI DI ALOGENAZIONE
- Visite: 24685
Nel propano esistono due tipi di idrogeni non equivalenti che possono essere sostituiti da alogeni, ottenendo 1-cloropropano e 2-cloropropano.
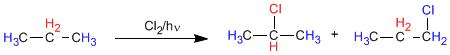
La proporzione in cui si ottengono questi prodotti dipende da due fattori: il numero di idrogeni da sostituire con l'alogeno e la stabilità del radicale formato.