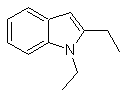
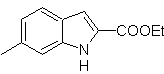
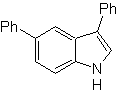
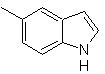
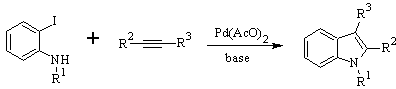Synthèse des INDOLES
(Par la méthode des déconnexions)
Le système cyclique indole a été trouvé dans de nombreux composés naturels d'un grand intérêt chimique et biochimique, c'est pourquoi on dit qu'il est le plus abondant dans la nature. Ainsi, le tryptophane est un acide aminé essentiel, l'indigo est un colorant et l'acide indolyl-3-acétique est une hormone de croissance végétale. D'autre part, l'intérêt de ces molécules vient de leur utilisation pharmacologique, comme par exemple le sumatriptan (antimigraineux) et le frovatriptan, également antimigraineux.
L'indole est un solide cristallin incolore avec un PF de 52°C, facilement soluble dans la plupart des solvants organiques et cristallise à partir de l'eau, a une odeur agréable et est donc également utilisé comme base de parfum.
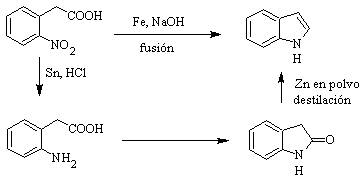
Il a été préparé pour la première fois en 1866 en chauffant de l'oxindole avec de la poussière de zinc et est devenu un produit commercial important. Baeyer en 1869 proposa la synthèse suivante :
Les méthodes classiques de synthèse des indoles sont celles de Fischer, Bischler, Reissert et Leimgruber-Batcho, Bartoli, Larock, Gassman, Sugasawa, Fukuyama, Hegedus et Dobbs.
1. Synthèse FISCHER
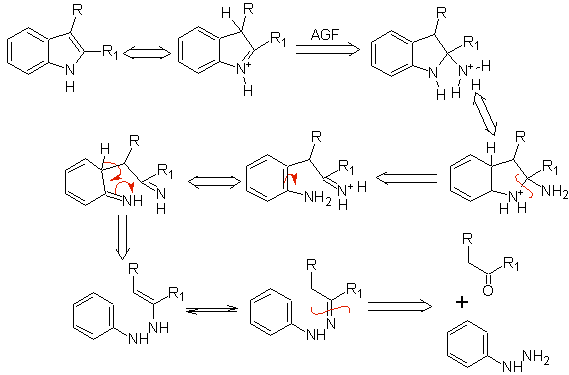
Il consiste à chauffer des phénylhydrazones de cétones ou d'aldéhydes, avec du chlorure de zinc anhydre, du trifluorure de bore, de l'acide polyphosphorique ou un autre catalyseur acide, pour produire des indoles. Un réarrangement catalysé par un acide d'une phénylhydrazone se produit avec élimination de l'eau et du NH 3 . Les groupes électrodonneurs favorisent la cyclisation et les électroattracteurs l'empêchent.
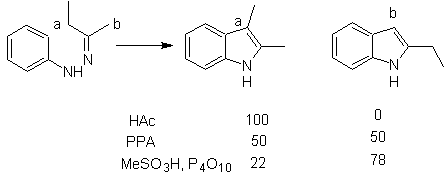
Avec les cétones asymétriques, la cyclisation intramoléculaire de l'hydrazone peut conduire à deux indoles isomères dans des proportions différentes selon les conditions utilisées ; en milieu fortement acide, l'indole le moins substitué peut prédominer.
Lorsqu'il y a des substituants méta, par rapport à l'azote de l'hydrazone, la cyclisation peut avoir lieu en deux positions, conduisant à deux indoles isomères :
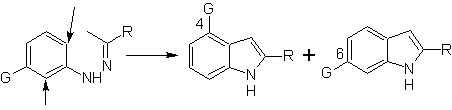
Si le substituant G est électro-attracteur, les deux isomères (4- et 6-) se forment à peu près dans la même proportion. En revanche, si G est un substituant donneur d'électrons, il se forme principalement l'isomère substitué en 6. L'analyse rétrosynthétique de l'indole formé par la synthèse de Fischer peut être considérée comme suit :
|
Proposer un plan de synthèse pour les molécules suivantes :
|
Mob 119
|
|
Mob 120
|
MOb 119. Analyse rétrosynthétique. La déconnexion fondamentale dans les indoles supposés être formés par la synthèse de Fischer correspond à une rétro-transposition, qui se traduit par la déconnexion de
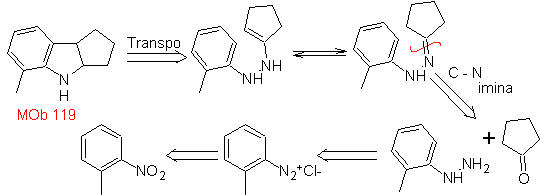
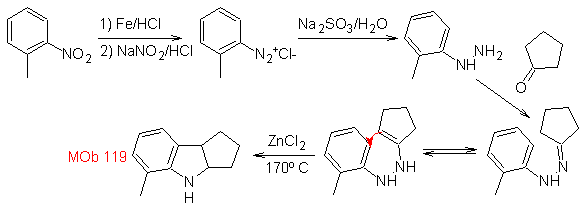
Synthèse : A partir d'ortho-nitrotoluène, on génère le dérivé intermédiaire de la phénylhydrazine, nécessaire à la synthèse des indoles de Fischer, on forme l'imine avec une cyclopentanone, et en chauffant
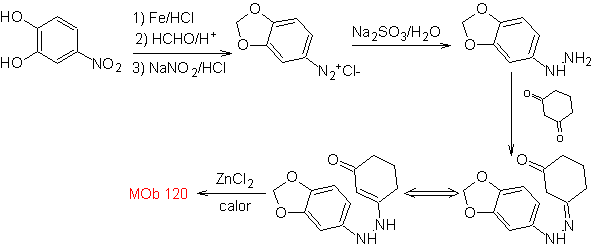
MOb 120. Analyse rétrosynthétique. La rétro-transposition de
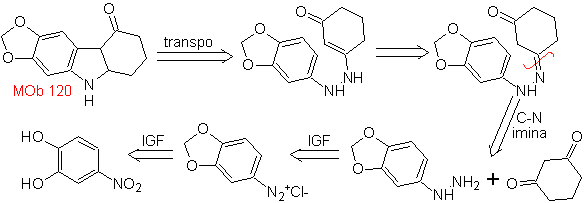
La synthèse. L'OH de la molécule de départ est protégé, formant un acétal cyclique et le groupe nitro est réduit pour diazoter ultérieurement l'amino.
La réduction du composé diazoïque formé avec le sulfite de sodium, permet d'obtenir le dérivé de la phénylfidrazine, qui est associé à la cyclohexanone, ce qui conduit alors à
1. Synthèse BISCHLER
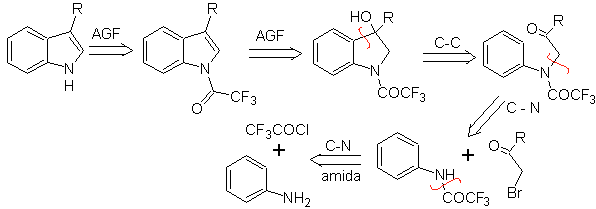
Il consiste en une cyclisation catalysée par un acide d'une α-arylaminocétone, qui est préparée à partir d'une aniline et d'un α-halocarbonyle. En utilisant des α-aminocétones N-acylées, la cyclisation est plus contrôlable et permet d'obtenir des indoles substitués dans le cycle hétérocyclique
|
Proposer un design de synthèse pour les molécules suivantes :
|
Mob 121
|
|
Mob 122
|
Mob 121 . Analyse rétrosynthétique.
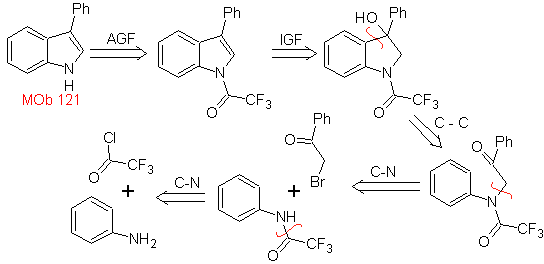
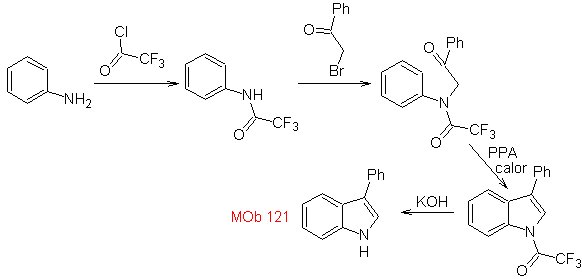
La synthèse. A partir de l'aniline, on peut obtenir l'amide recherché, qui va ensuite réagir avec l'α-bromo benzophénone, pour former une molécule qui se cyclise avec le PPA. L'application d'une base telle que le KOH et la chaleur, forme
Mob 122 . Analyse rétrosynthétique.
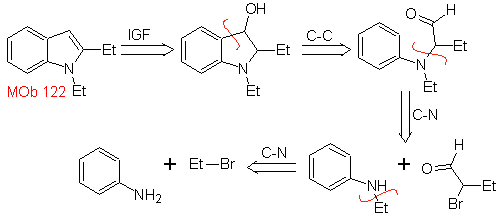
La synthèse. Encore une fois, la synthèse de
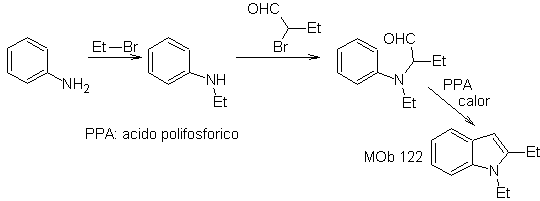
Dans cette méthode, il est essentiel que les hydrogènes du substituant en position ortho par rapport au groupe nitro soient suffisamment acides, et donc le nucléophile est garanti dans sa formation, pour se combiner avec un composé carbonyle.
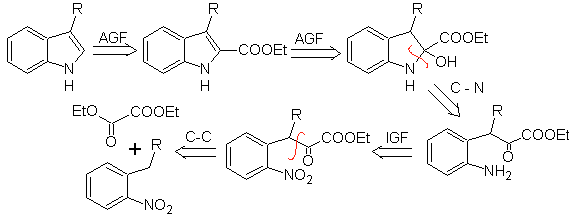
|
Proposer un plan de synthèse pour les molécules suivantes :
|
Mob 123
|
|
Mob 124
|
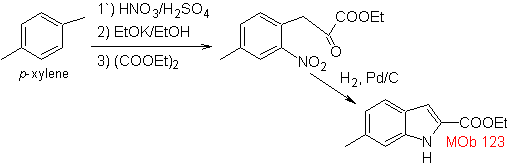
Mob 123 . Analyse rétrosynthétique.
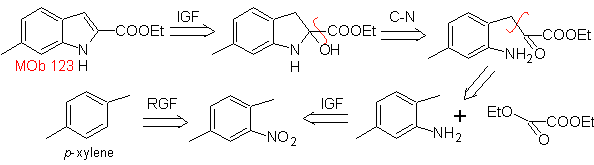
La synthèse. le p-xylène est transformé en un dérivé nitré, en tant qu'intermédiaire requis, pour cycliser, décarboxyler et ainsi former
Mob 124 . Analyse rétrosynthétique.
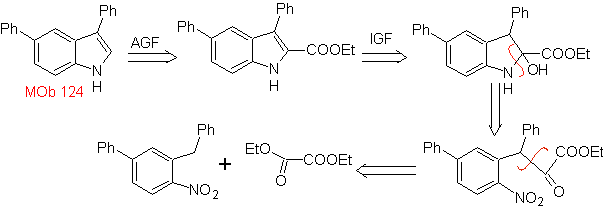
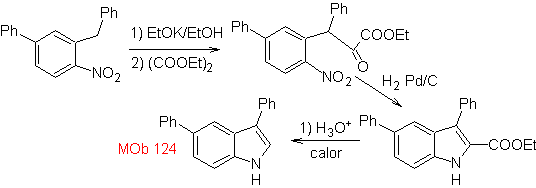
La synthèse. La matière première proposée pour la synthèse de
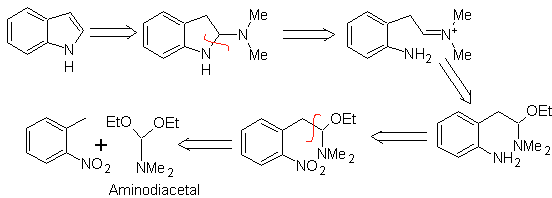
3. Synthèse LEIMGRUBER-BATCHO
Comme dans la méthode précédente, l'acidité du substituant en ortho du groupement nitro doit être garantie, l'électrophile nécessaire est apporté par l'aminodiacétal.
|
Proposer un plan de synthèse pour les molécules suivantes :
|
Mob 125
|
|
Mob 126
|
MOb 125. Analyse rétrosynthétique. La stratégie de déconnexion qui ressort de la synthèse de Leimgruber-Batcho est utilisée pour
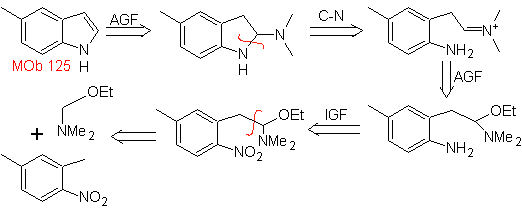
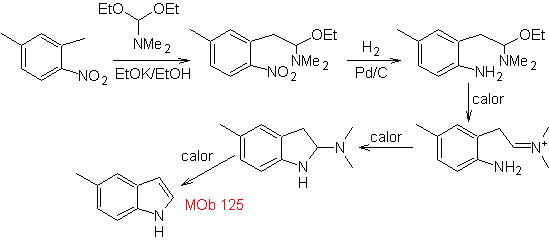
La synthèse. L'intermédiaire 2,4-diméthyl-1-nitrobenzène peut être préparé à partir du benzène et poursuivre les réactions prévues dans la méthode Leimgruber-Batcho, pour la synthèse de
Mob 126 . Analyse rétrosynthétique. Le groupe méthyle en C2 de l'indole force les déconnexions à être liées à la présence d'un groupe acétylénique, qui finira par se combiner avec le groupe amino.
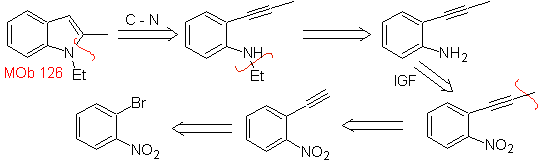
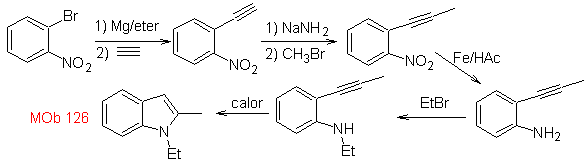
La synthèse. Pour introduire le groupe acétylène dans le benzène, un organomagnésien est mis à réagir avec de l'acétylène. La cyclisation est produite par une réaction du groupe amino avec la triple liaison. Les réactions suivantes permettent de former
Synthèse HEGEDUS :
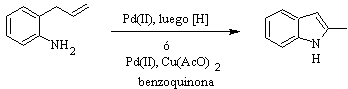
Synthèse FUKUYAMA :
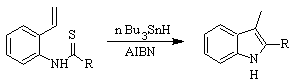
Synthèse SUGASAWA :
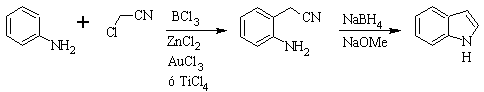
Synthèse de Gassman :
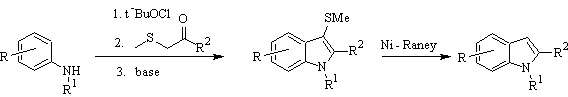
Synthèse BARTOLI :
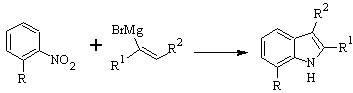
Synthèse DOBBS :
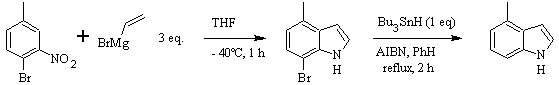
Synthèse CASTRO :
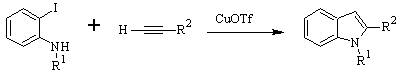
Synthèse LAROCK :